Stoom: verschil tussen versies
imported>Jan Pieter Rottine Geen bewerkingssamenvatting |
imported>Jan Pieter Rottine Geen bewerkingssamenvatting |
||
| Regel 69: | Regel 69: | ||
Wij zien dit in onderstaande figuur '''grafisch voorgesteld''': | Wij zien dit in onderstaande figuur '''grafisch voorgesteld''': | ||
[[Bestand: | [[Bestand:Water_tabel_gtgi.jpeg|600×309px|link=]] | ||
===='''Water en stoom'''==== | ===='''Water en stoom'''==== | ||
Versie van 2 mrt 2013 17:41
Stoom wordt geproduceerd uit water
Water
Water komt vrij in de natuur voor. Het is een chemische verbinding van één gewichtsdeel waterstof met acht gewichtsdelen zuurstof.
Aggregatietoestand
Afhangende van de temperatuur, die het heeft, en de druk, die er op wordt uitgeoefend, komt het voor in vaste, vloeibare of gasvormige toestand.
Deze drie toestanden noemt men bij alle stoffen: de drie aggregatietoestanden.
Bij de overgang van de ene toestand in de andere, die plaatsvindt bij een bepaalde verandering van druk of temperatuur, of van beide tegelijk, verandert de chemische samenstelling niet.
Water komt in vaste toestand voor in de vorm van ijs, in de gasvormige toestand, waterdamp of stoom genoemd, is het onzichtbaar.
Een veel voorkomend misverstand is dat men de zichtbare dampwolken bij een stoominstallatie stoom noemt: het is echter een zichtbare wolk van (zeer) fijne waterdruppeltjes, dus fijn verdeeld water.
Smeltpunt
Omdat de temperatuur, waarbij het ijs begint te smelten, (over het algemeen beschouwd) altijd gelijk is, dus niet afhangt van de luchtdruk, heeft men bij de verschillende thermometerschalen dit smeltpunt tot uitgangspunt genomen. (Helemaal juist is het bovenstaande niet, want bij een aanzienlijke drukvermeerdering wordt het smeltpunt van ijs verlaagd!)
Celcius en Réaumur hebben bij hun schaalverdeling dit punt nul (0) genoemd, Fahrenheit gaf het smeltpunt echter het getal 32.
Het smeltpunt van ijs is in de regel ook het punt, waarbij omgekeerd het water begint te bevriezen.
Echter, wanneer het water in volkomen rust verkeert, kan het voorkomen, dat de temperatuur tot behoorlijk beneden het vriespunt daalt, zonder dat het in vaste toestand overgaat.
Het water verkeert dan in een soort van spanning, bij de kleinste beweging, verandert het dan spontaan door de hele massa heen in ijs.
Bij de overgang van van vloeibaar naar vast zet het water bovendien ook uit. Dit gaat gepaard met grote kracht: wat heel gemakkelijk de aanleiding kan zijn tot het springen van water/ijs bevattende buizen, leidingen en vaten.
Kookpunt
Vaak wordt de temperatuur, waarbij het water kookt (dat wil zeggen: als het door de hele massa heen in damp overgaat, dus dampbellen overal in de massa ontstaan) als tweede ijkpunt voor de thermometerschalen genomen.
Dit kookpunt moet dan wel bij een nauwkeurig bepaalde luchtdruk worden waargenomen en daarvoor neemt men meestal de gemiddelde barometherstand van 76 cm. kwikzuilhoogte aan. (1 atm.)
Druk
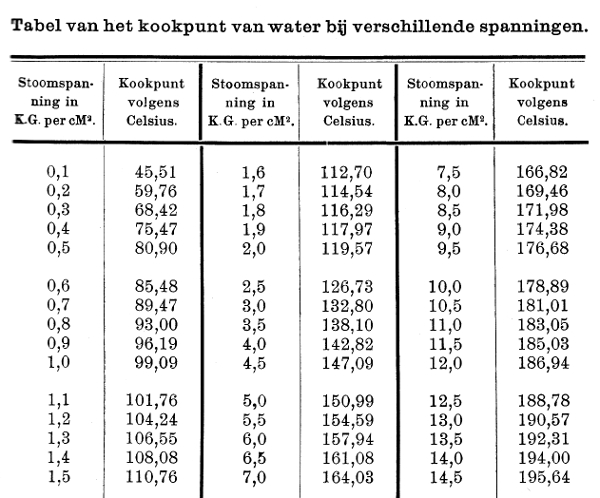
Men heeft voor de verschillende drukken (zowel de drukken van de atmosfeer als de drukken in gesloten vaten) het kookpunt van water bepaald en hiervan zijn uitvoerige tabellen opgesteld.
Uitgangspunt is daarbij steeds de druk van de atmosfeer, gemeten door middel van de hoogte van de kwikzuil in het luchtledige van een gesloten buis. Als de doorsnede van de buis 1 cm2 is, en de hoogte van de kwikzuil 76 cm3 kwik is, dan is het gewicht (de druk van de atmosfeer) 76 x 0,013595 = 1,033 kg.
1 Atmosfeer is de druk van 1 kg per cm2. Deze druk komt overeen met een barometerstand van 73,55 cm kwik bij o gr. C.
In het stoombedrijf dienen manometers voor de meting van de stoomspanning, met een schaalverdeling die de atmosfeer als eenheid gebruiken. Daarbij wordt vaak de toevoeging: Kiligrammen per cm2 gegeven.
Thermometerschalen
De schaallengte tussen de beide punten: smeltpunt en kooppunt wordt vervolgens door de natuurkundigen in een aantal gelijke delen verdeeld: Celcius in 100 delen, Réaumur in in 80 delen en Fahrenheit in 180.
Dat betekent, dat er veel omgerekend moet worden, als men de temperatuurschalen door elkaar wil gebruiken.
in de afgelopen eeuwen (19e en 20e) maakte men, vaak regiogebonden, nog wel van gebruik van de verschillende schalen. Tegenwoordig gebruikt men overwegend de schaal van Celcius in het dagelijks gebruik, in wetenschappelijk verband vaak de schaal van Kelvin: deze beide schalen lopen voor een deel parallel.
Stoom
Koken en druk
In een stoomketel (gesloten vat) heerst een vast verband tussen de druk (spanning) en de temperatuur als we letten op het kookpunt. Deze relatie kan men aflezen in de gegeven tabel.
Deze situatie is het punt waarbij de heersende temperatuur als kookpunt met de bijbehorende druk overeenkomt: in een dergelijke ketel bestaat stoom en water.
Zou in deze ketel door het uitlaten van stoom de spanning plotseling verminderen, dan vindt er eerst een plotselinge levendige stoomvorming plaats, die geleidelijk vermindert, tot het punt, waarbij de heersende temperatuur als kookpunt weer overeenkomt met de bijbehorende druk, enz.
Bovengenoemd punt heet het verzadigingspunt: de temperatuur en druk in de stoomketel zijn zodanig geregeld, dat het kookpunt is bereikt: er is stoom gevormd en er is sprake van verzadiging. Er heerst evenwicht.
In een stoomketel is er echter vaak een zekere fluctuatie: door de afname van stoom uit de ketel, ontstaat er een lagere spanning in de ketel dan die, welke volgens de tabel met de temperatuur overeenkomt: dus gaat het water heftiger koken, de stoomvorming gaat door tot de bijbehorende tabeldruk weer is bereikt. Ook een hogere spanning is in deze ketel maar kort bestaanbaar: omdat de stoom door de natuurkundige wetten ogenblikkelijk verdicht wordt, d.w.z. condenseert, totdat ook dan de temperatuur en druk weer volgens de tabel in evenwicht zijn.
De stoom van deze situatie noemen we verzadigde stoom
Als in een ruimte, die helemaal met verzadigde stoom gevuld is, warmte toevoert, dan stijgt de temperatuur.
Als er in een dergelijke ruimte geen uitzetting kan plaatsvinden, dan zal het resultaat zijn dat ook de druk gaat stijgen.
Deze stoom bezit dus bij de gelijke aanvangsspanning een hogere temperatuur dan de verzadigde stoom, en deze stoom wordt daarom oververhitte stoom genoemd.
Dergelijke oververhitte stoom kan zich ook vormen, als de uit de ketel ontwijkende stoom door een verhit buizenstelsel (oververhitter) wordt gevoerd of op een andere manier wordt verwarmd. Deze oververhitte stoom komt dan niet meer met het koudere water in aanraking en behoudt daarom dezelfde spanning en kan zijn extra werking uitoefenen door het grotere volume en de hogere warmte-energiehoeveelheid.
Condensatie
Als er, omgekeerd, aan verzadigde stoom, warmte wordt onttrokken, dan volgt er een gedeeltelijke condensatie, omdat het water zich door de te hoge (tabel)druk gaat verdichten. Er ontstaat een mengsel van water en damp, die laatste damp blijft verzadigd, maar dan bij het verlaagde temperatuurpunt. Wij spreken van gecondenseerde stoom als de stoom is gecondenseerd tot condensaat-water.
Nogmaals water
We kunnen voor water dus vaststellen:
Terwijl bij stoom dus de temperatuur wel hoger, maar niet lager kan zijn, dan bij de verzadigde stoom van gelijke druk, kan de temperatuur bij water wel lager, maar niet hoger zijn!
Wij zien dit in onderstaande figuur grafisch voorgesteld:
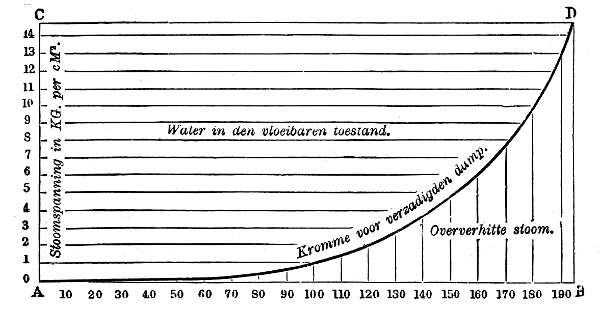
Water en stoom
Om water te verwarmen is een bepaalde warmte-hoeveelheid nodig.
daarvoor is een definitie-afspraak gemaakt:
De warmte hoeveelheid die nodig is om 1 kg water één graad C. in temperatuur te doen stijgen, noemen wij 1 calorie. In de stoomtechniek wordt 1 calorie ook wel met 1 W E aangeduide (WE=warmte-Eenheid)
Warmte en water/stoom
Vervolgens heeft men proefondervindelijk vastgesteld, hoeveel warmte-eenheden er nodig zijn om 1 kg water van 0 gr. C. in verzadigde waterdamp van een zekere temperatuur t om te zetten.
Als men deze warmtehoeveelheid Q noemt, dan wordt de berekeningsformule:
Q=606,50 + 0,305t
Als voorbeeld: Als men voor de verzadigingstemperatuur 150 gr. (bij ongeveert 5 atm.) neemt:
Q=606,50 + 0,305 x 150 = 652,25 W E (calorieën)
bij 100 gr. C. wordt dit: 637 W E (calorieën)
Gewicht en stoom
Het gewicht van 1 m3 (kubieke meter) verzadigde waterdamp (verzadigde stoom) is afhankelijk van de druk en temperatuur. Voor de verschillende spanningen vindt men het bijbehorende gewicht in een tabel:
tabel pag. 26
Een rekenvoorbeeld: Gevraagd: Een stoomketel moet per uur 500 m3 stoom van 5 atm overdruk leveren. Hoe groot is de vereiste hoeveelheid voedingswater?
Berekeningen:
De werkelijke spanning in de ketel is 5 + 1 = 6atm., het gewicht van een kubieke meter stoom is volgens de tabel 3,132 kg.
500 kubieke meters wegen dan 500 x 3,132 = 1566 kg. Dit is ook het gewicht van de vereiste hoeveelheid voedingswater per uur, of het aantal liters. Dit alles bij 0 gr. C.
Gaan we nu uit van 6 atm. bij 158 gr. C (volgens de tabel), dan is de hoeveelheid benodigde warmte:
Q = 606,50 + 0,305 x 158 = 654,69 W E per kg.
Voor 1566 KG wordt de gevraagde totale warmtehoeveelheid dan:
1566 x 654,69 = 1025244,54 W E (calorieën) = 1025 Kcal